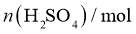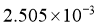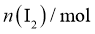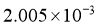2021年浙江高考化学真题答案解析
2021年6月浙江省普通高校招生选考科目考试
化学试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 P 31 S 32 Cl 35.5 Fe 56 Cu 64 Br 80 Ag 108 I 127 Ba 137
一、选择题(本大题共25小题,每小题2分,共50分.每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1.下列物质属于纯净物的是( )
A.汽油 B.食醋 C.漂 D.小苏打
2.下列物质属于弱电解质的是( )
A.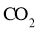 B.
B.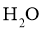 C.
C.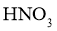 D.
D.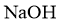
3.下列物质的化学成分不正确的是( )
A.生石灰: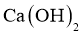 B.重晶石:
B.重晶石: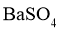
C.尿素: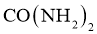 D.草酸:
D.草酸: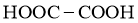
4.下列图示表示灼烧操作的是( )
A. B.
B. C.
C. D.
D.
5.下列表示不正确的是( )
A.乙炔的实验式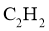 B.乙醛的结构简式
B.乙醛的结构简式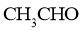
C.2,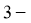 二甲基丁烷的键线式
二甲基丁烷的键线式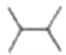 D.乙烷的球棍模型
D.乙烷的球棍模型
6.下列说法正确的是( )
A.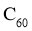 和
和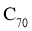 互为同位素 B.
互为同位素 B.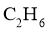 和
和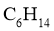 互为同系物
互为同系物
C.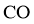 和
和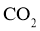 互为同素异形体 D.
互为同素异形体 D.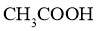 和
和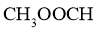 是同一种物质
是同一种物质
7.关于有机反应类型,下列判断不正确的是( )
A.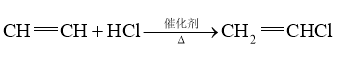 (加成反应)
(加成反应)
B.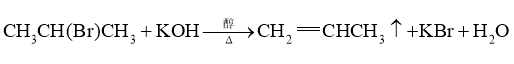 (消去反应)
(消去反应)
C.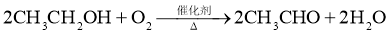 (还原反应)
(还原反应)
D. (取代反应)
(取代反应)
8.关于反应 ,下列说法正确的是( )
,下列说法正确的是( )
A. 发生氧化反应 B.
发生氧化反应 B. 是还原产物
是还原产物
C.生成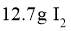 时,转移
时,转移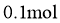 电子 D.还原剂与氧化剂的物质的量之比为7
电子 D.还原剂与氧化剂的物质的量之比为7
9.下列说法不正确的是( )
A.硅酸钠是一种难溶于水的硅酸盐 B.镁在空气中燃烧可生成氧化镁和氮化镁
C.钠与水反应生成氢氧化钠和氢气 D.常温下,铝遇浓硝酸或浓硫酸时会发生钝化
10.下列说法不正确的是( )
A.应避免铵态氮肥与草木灰混合施用
B.工业上可用离子交换法提高海带中碘的提取率
C.电解饱和食盐水可以得到金属钠和
D.将生铁进一步炼制减少含碳量,能得到耐腐蚀的钢
11.下列说法正确的是( )
A.减压过滤适用于过滤胶状氢氧化物类沉淀
B.实验室电器设备着火,可用二氧化碳灭火器灭火
C.制备硫酸亚铁铵晶体时,须将含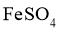 和
和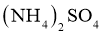 的溶液浓缩至干
的溶液浓缩至干
D.将热的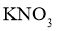 饱和溶液置于冰水中快速冷却即可制得颗粒较大的晶体
饱和溶液置于冰水中快速冷却即可制得颗粒较大的晶体
12.下列“类比”结果不正确的是( )
A.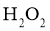 的热稳定性比
的热稳定性比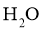 的弱,则
的弱,则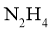 的热稳定性比
的热稳定性比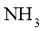 的弱
的弱
B.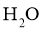 的分子构型为V形,则二甲醚的分子骨架(
的分子构型为V形,则二甲醚的分子骨架(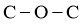 )构型为V形
)构型为V形
C.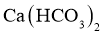 的溶解度比
的溶解度比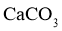 的大,则
的大,则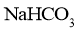 的溶解度比
的溶解度比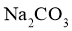 的大
的大
D.将丙三醇加入新制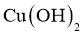 中溶液呈绛蓝色,则将葡萄糖溶液加入新制
中溶液呈绛蓝色,则将葡萄糖溶液加入新制 中溶液也呈绛蓝色
中溶液也呈绛蓝色
13.不能正确表示下列变化的离子方程式是( )
A.碳酸镁与稀盐酸反应: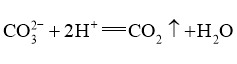
B.亚硫酸氢钠的水解: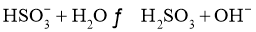
C.锌溶于氢氧化钠溶液: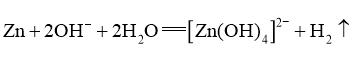
D.亚硝酸钠与氯化铵溶液受热反应: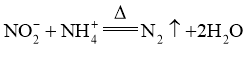
14.关于油脂,下列说法不正确的是( )
A.硬脂酸甘油酯可表示为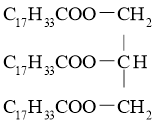
B.花生油能使酸性高锰酸钾溶液褪色
C.植物油通过催化加氢可转变为氢化油
D.油脂是一种重要的工业原料,可用于制造肥皂、油漆等
15.已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如下所示,其中Y的最高化合价为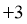 .下列说法不正确的是( )
.下列说法不正确的是( )
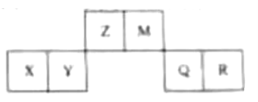
A.还原性: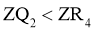
B.X能从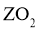 中置换出Z
中置换出Z
C.Y能与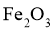 反应得到
反应得到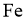
D.M最高价氧化物的水化物能与其最低价氢化物反应
16.关于化合物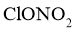 的性质,下列推测不合理的是( )
的性质,下列推测不合理的是( )
A.具有强氧化性 B.与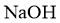 溶液反应可生成两种钠盐
溶液反应可生成两种钠盐
C.与盐酸作用能产生 D.水解生成盐酸和硝酸
17.相同温度和压强下,关于物质熵的大小比较,合理的是( )
A.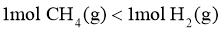 B.
B.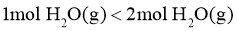
C.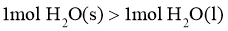 D.
D.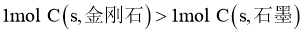
18.设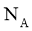 为阿伏加德罗常数的值,下列说法不正确的是( )
为阿伏加德罗常数的值,下列说法不正确的是( )
A.标准状况下,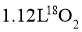 中含有中子数为
中含有中子数为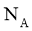
B.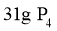 (分子结构:
(分子结构: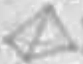 )中的共价键数目为
)中的共价键数目为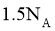
C.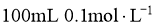 的
的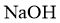 水溶液中含有氧原子数为
水溶液中含有氧原子数为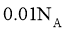
D.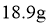 三肽
三肽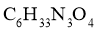 (相对分子质量:189)中的肽键数目为
(相对分子质量:189)中的肽键数目为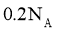
19.某同学拟用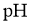 计测定溶液
计测定溶液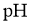 以探究某酸
以探究某酸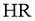 是否为弱电解质。下列说法正确的是( )
是否为弱电解质。下列说法正确的是( )
A.25℃时,若测得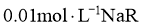 溶液
溶液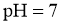 ,则
,则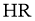 是弱酸
是弱酸
B.25℃时,若测得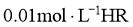 溶液
溶液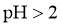 且
且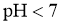 ,则
,则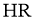 是弱酸
是弱酸
C.25℃时,若测得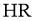 溶液
溶液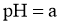 ,取该溶液
,取该溶液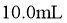 ,加蒸馏水稀释至
,加蒸馏水稀释至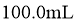 ,测得
,测得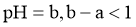 ,则
,则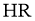 是弱酸
是弱酸
D.25℃时,若测得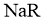 溶液
溶液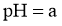 ,取该溶液
,取该溶液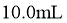 ,升温至50℃,测得
,升温至50℃,测得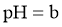 ,
,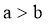 ,则
,则 是弱酸
是弱酸
20.一定温度下:在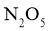 的四氯化碳溶液(
的四氯化碳溶液(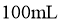 )中发生分解反应:
)中发生分解反应: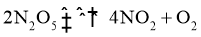 。在不同时刻测量放出的
。在不同时刻测量放出的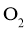 体积,换算成
体积,换算成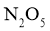 浓度如下表:
浓度如下表:
|
|
0 |
600 |
1200 |
1710 |
2220 |
2820 |
x |
|
|
1.40 |
0.96 |
0.66 |
0.48 |
0.35 |
0.24 |
0.12 |
下列说法正确的是( )
A.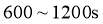 ,生成
,生成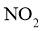 的平均速率为
的平均速率为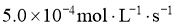
B.反应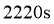 时,放出的
时,放出的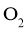 体积为
体积为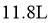 (标准状况)
(标准状况)
C.反应达到平衡时,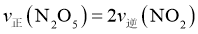
D.推测上表中的x为3930
21.相同温度和压强下,关于反应的 ,下列判断正确的是( )
,下列判断正确的是( )
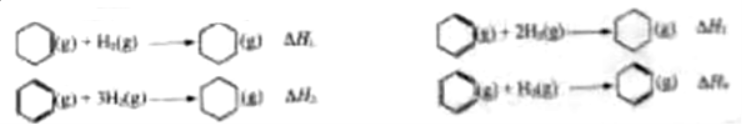
A.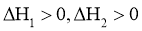 B.
B.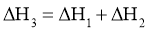
C.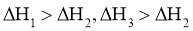 D.
D.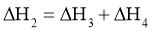
22.某全固态薄膜锂离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时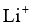 得电子成为
得电子成为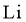 嵌入该薄膜材料中;电极B为
嵌入该薄膜材料中;电极B为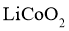 薄膜;集流体起导电作用.下列说法不正确的是( )
薄膜;集流体起导电作用.下列说法不正确的是( )

A.充电时,集流体A与外接电源的负极相连
B.放电时,外电路通过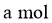 电子时,
电子时,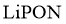 薄膜电解质损失
薄膜电解质损失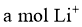
C.放电时,电极B为正极,反应可表示为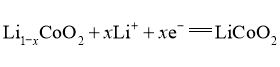
D.电池总反应可表示为
23.取两份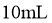
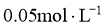 的
的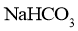 溶液,一份滴加
溶液,一份滴加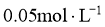 的盐酸,另一份滴加
的盐酸,另一份滴加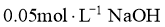 溶液,溶液的pH随加入酸(或碱)体积的变化如图。
溶液,溶液的pH随加入酸(或碱)体积的变化如图。
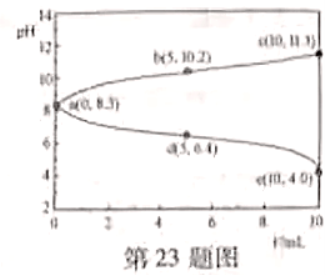
下列说法不正确的是( )
A.由a点可知: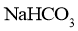 溶液中
溶液中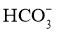 的水解程度大于电离程度
的水解程度大于电离程度
B.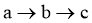 过程中:
过程中: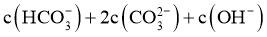 逐渐减小
逐渐减小
C.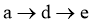 过程中:
过程中: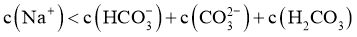
D.令c点的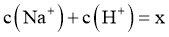 ,e点的
,e点的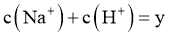 ,则
,则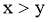
24.制备苯甲酸甲酯的一种反应机理如图(其中 代表苯基)。下列说法不正确的是( )
代表苯基)。下列说法不正确的是( )
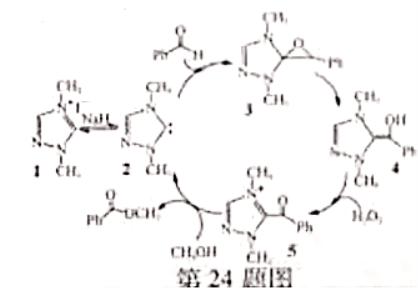
A.可以用苯甲醛和甲醇为原料制备苯甲酸甲酯 B.反应过程涉及氧化反应
C.化合物3和4互为同分异构体 D.化合物1直接催化反应的进行
25.下列方案设计、现象和结论都正确的是( )
|
|
目的 |
方案设计 |
现象和结论 |
|
A |
探究乙醇消去反应的产物 |
取 |
若溴水褪色,则乙醇消去反应的产物为乙烯 |
|
B |
探究乙酰水杨酸样品中是否含有水杨酸 |
取少量样品,加入 |
若有紫色沉淀生成,则该产品中含有水杨酸 |
|
C |
探究金属钠在氧气中燃烧所得固体粉末的成分 |
取少量固体粉末,加入 |
若无气体生成,则固体粉末为 |
|
D |
探究 |
取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量 |
若有白色沉淀产生,则样品已经变质 |
26.(4分)(1)已知3种原子晶体的熔点数据如下表:
|
|
金刚石 |
碳化硅 |
晶体硅 |
|
熔点/℃ |
|
2600 |
1415 |
金刚石熔点比晶体硅熔点高的原因是______________.
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的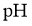 使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是_________.
使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是_________.
27.(4分)将 某有机物(仅含C、H、O元素,相对分子质量为150)样品置于燃烧器中充分燃烧,依次通过吸水剂、
某有机物(仅含C、H、O元素,相对分子质量为150)样品置于燃烧器中充分燃烧,依次通过吸水剂、 吸收剂,燃烧产物被完全吸收.实验数据如下表:
吸收剂,燃烧产物被完全吸收.实验数据如下表:
|
|
吸水剂 |
|
|
实验前质量/g |
20.00 |
26.48 |
|
实验后质量/g |
21.08 |
30.00 |
请回答:
(1)燃烧产物中水的物质的量为_______ 。
。
(2)该有机物的分子式为_________(写出计算过程)。
28.(10分)固体化合物X由3种元素组成,某学习小组开展如下探究实验。
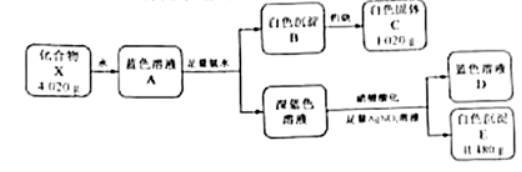
其中,白色沉淀B能溶于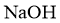 溶液。
溶液。
请回答:
(1)白色固体C的化学式是____________,蓝色溶液D中含有的溶质是_________(用化学式表示)。
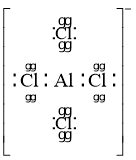
(2)化合物X的化学式是__________;化合物X的一价阴离子与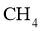 具有相同的空间结构,写出该阴离子的电子式____________。
具有相同的空间结构,写出该阴离子的电子式____________。
(3)蓝色溶液A与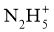 作用,生成一种气体,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀。
作用,生成一种气体,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀。
①写出该反应的离子方程式_____________.②设计实验验证该白色沉淀的组成元素___________。
29.(10分)含硫化合物是实验室和工业上的常用化学品。
请回答:
(1)实验室可用铜与浓硫酸反应制备少量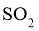 :
:
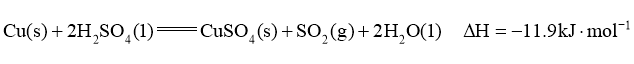
判断该反应的自发性并说明理由__________。
(2)已知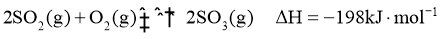
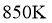 时,在一恒容密闭反应器中充入一定量的
时,在一恒容密闭反应器中充入一定量的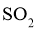 和
和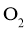 ,当反应达到平衡后测得
,当反应达到平衡后测得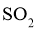 、
、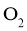 和
和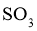 的浓度分别为
的浓度分别为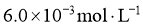 、
、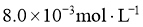 和
和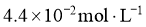 。
。
①该温度下反应的平衡常数为_____。②平衡时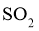 的转化率为_______。
的转化率为_______。
(3)工业上主要采用接触法由含硫矿石制备硫酸。
①下列说法正确的是___________。
A.须采用高温高压的反应条件使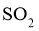 氧化为
氧化为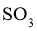
B.进入接触室之前的气流无需净化处理
C.通入过量的空气可以提高含硫矿石和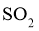 的转化率
的转化率
D.在吸收塔中宜采用水或稀硫酸吸收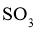 以提高吸收速率
以提高吸收速率
②接触室结构如图1所示,其中1~4表示催化剂层。图2所示进程中表示热交换过程的是___________。
A. B.
B. C.
C.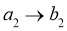 D.
D.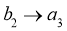 E.
E.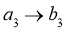 F.
F.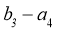 G.
G.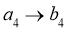
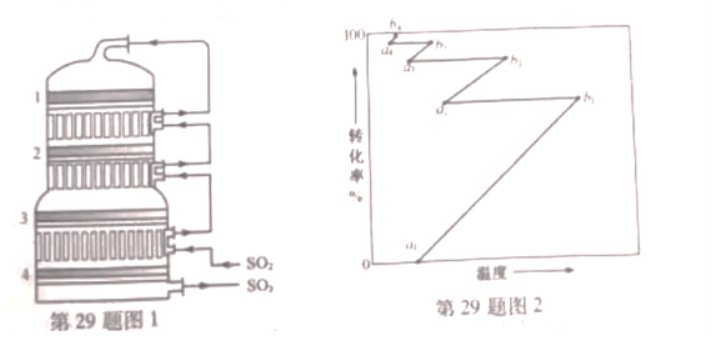
③对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图3中画出反应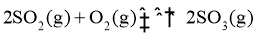 的转化率与最适宜温度(曲线Ⅰ)、平衡转化率与温度(曲线Ⅱ)的关系曲线示意图(标明曲线Ⅰ、Ⅱ)。
的转化率与最适宜温度(曲线Ⅰ)、平衡转化率与温度(曲线Ⅱ)的关系曲线示意图(标明曲线Ⅰ、Ⅱ)。
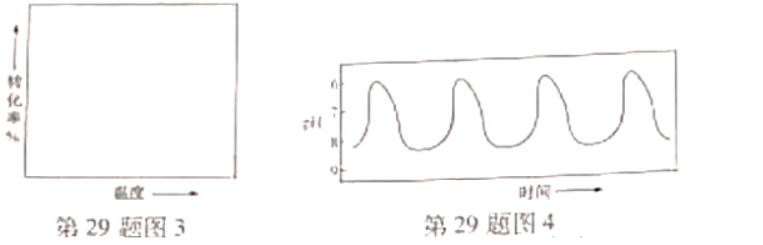
(4)一定条件下,在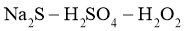 溶液体系中,检测得到
溶液体系中,检测得到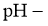 时间振荡曲线如图4,同时观察到体系由澄清→浑浊→澄清的周期性变化。可用一组离子方程式表示每一个周期内的反应进程,请补充其中的2个离子方程式。
时间振荡曲线如图4,同时观察到体系由澄清→浑浊→澄清的周期性变化。可用一组离子方程式表示每一个周期内的反应进程,请补充其中的2个离子方程式。
Ⅰ.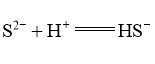 Ⅱ.①___________; Ⅲ.
Ⅱ.①___________; Ⅲ.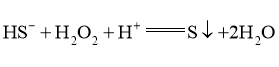 ;
;
Ⅳ.②____________。
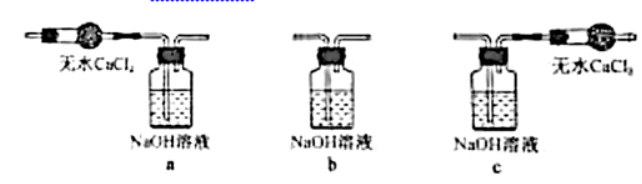
30.(10分)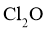 是很好的氯化剂,实验室用下图装置(夹持仪器已省略)制备高纯
是很好的氯化剂,实验室用下图装置(夹持仪器已省略)制备高纯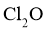 。已知:
。已知:
①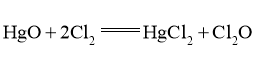 ,合适反应温度为
,合适反应温度为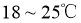 ;
;
副反应: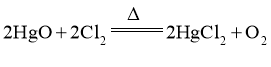 。
。
②常压下,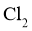 沸点
沸点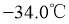 ,熔点
,熔点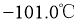 ;
;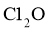 沸点2.0℃,熔点
沸点2.0℃,熔点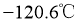 。
。
③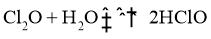 ,
,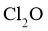 在
在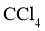 中的溶解度远大于其在水中的溶解度。
中的溶解度远大于其在水中的溶解度。
请回答:
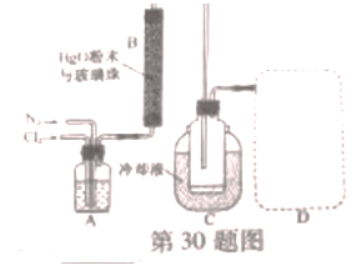
(1)①装置A的作用是去除原料气中的少量水分,可用的试剂是____________。
②将上图中装置组装完整,虚框D中应选用___________。
(2)有关反应柱B,须进行的操作是_____________。
A.将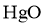 粉末热处理除水分、增加表面积后填入反应柱
粉末热处理除水分、增加表面积后填入反应柱
B.调控进入反应柱的混合气中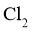 和
和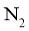 的比例
的比例
C.调控混合气从下口进入反应柱的流速
D.将加热带缠绕于反应柱并加热
(3)装置C,冷却液的温度通常控制在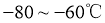 .反应停止后,温度保持不变,为减少产品中的
.反应停止后,温度保持不变,为减少产品中的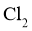 含量,可采用的方法是______________。
含量,可采用的方法是______________。
(4)将纯化后的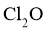 产品气化,通入水中得到高纯度
产品气化,通入水中得到高纯度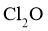 的浓溶液,于阴凉暗处贮存.当需要
的浓溶液,于阴凉暗处贮存.当需要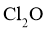 时,可将
时,可将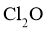 浓溶液用
浓溶液用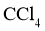 萃取分液,经气化重新得到。
萃取分液,经气化重新得到。
针对萃取分液,从下列选项选择合适操作(操作不能重复使用)并排序:c→( )→( )→e→d→f→( )。
a.检查旋塞、玻璃塞处是否漏水 b.将溶液和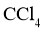 转入分液漏斗 c.涂凡士林
转入分液漏斗 c.涂凡士林
d.旋开旋塞放气 e.倒转分液漏斗,小心振摇 f.经几次振摇并放气后,将分液漏斗置于铁架台上静置
g.打开旋塞,向锥形瓶放出下层液体 h.打开旋塞,待下层液体完全流出后,关闭旋塞,将上层液体倒入锥形瓶
(5)产品分析:取一定量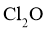 浓溶液的稀释液,加入适量
浓溶液的稀释液,加入适量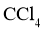 、过量
、过量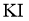 溶液及一定量的稀
溶液及一定量的稀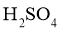 ,充分反应。用标准
,充分反应。用标准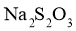 溶液滴定(滴定Ⅰ);再以酚酞为指示剂,用标准
溶液滴定(滴定Ⅰ);再以酚酞为指示剂,用标准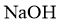 溶液滴定(滴定Ⅱ)。
溶液滴定(滴定Ⅱ)。
已知产生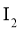 的反应(不考虑
的反应(不考虑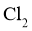 与水反应):
与水反应):
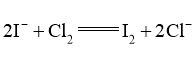
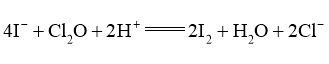
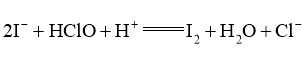
实验数据如下表:
|
加入量 |
|
|
滴定Ⅰ测出量 |
|
|
滴定Ⅱ测出量 |
|
标准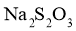 溶液滴定时,无需另加指示剂。判断滴定Ⅰ到达终点的实验现象是________________。
溶液滴定时,无需另加指示剂。判断滴定Ⅰ到达终点的实验现象是________________。
②高纯度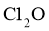 浓溶液中要求
浓溶液中要求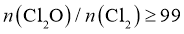 (
(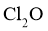 和
和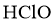 均以
均以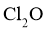 计)。结合数据分析所制备的
计)。结合数据分析所制备的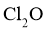 浓溶液是否符合要求____________。
浓溶液是否符合要求____________。
31.(12分)某课题组研制了一种具有较高玻璃化转变温度的聚合物P,合成路线如下:
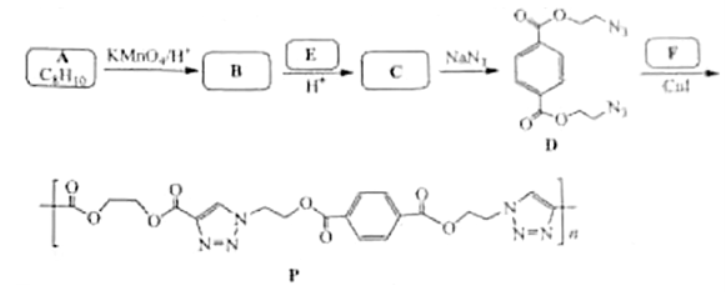
已知: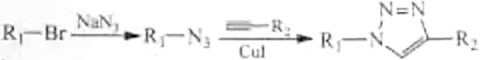
请回答:
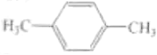
(1)化合物A的结构简式是________;化合物E的结构简式是________。
(2)下列说法不正确的是_______。
A.化合物B分子中所有的碳原子共平面
B.化合物D的分子式为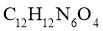
C.化合物D和F发生缩聚反应生成P
D.聚合物P属于聚酯类物质
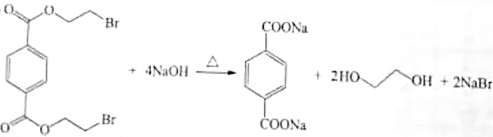
(3)化合物C与过量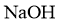 溶液反应的化学方程式是_______。
溶液反应的化学方程式是_______。
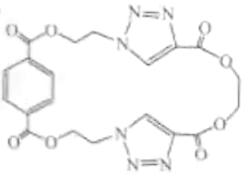
(4)在制备聚合物P的过程中还生成了一种分子式为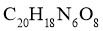 的环状化合物。用键线式表示其结构_____。
的环状化合物。用键线式表示其结构_____。
(5)写出3种同时满足下列条件的化合物F的同分异构体的结构简式(不考虑立体异构体):_______。
① 谱显示只有2种不同化学环境的氢原子 ②只含有六元环
谱显示只有2种不同化学环境的氢原子 ②只含有六元环
③含有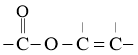 结构片段,不含
结构片段,不含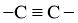 键
键
(6)以乙烯和丙炔酸为原料,设计如下化合物的合成路线(用流程图表示,无机试剂、有机溶剂任选)_____。

参考答案
一、选择题(本大题共25小题,每小题2分,共50分)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
D |
B |
A |
B |
A |
B |
C |
D |
A |
C |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
B |
C |
A |
A |
A |
D |
B |
C |
B |
D |
|
21 |
22 |
23 |
24 |
25 |
|
|
|
|
|
|
C |
B |
C |
D |
D |
|
|
|
|
|
二、非选择题(本大题共6小题,共50分)
26.(4分)
(1)原子半径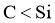 (或键长
(或键长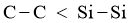 ),键能
),键能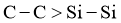
(2)当调节溶液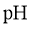 至甘氨酸主要以两性离子的形态存在时(即等电点,此时两性离子间相互吸引力最大),溶解度最小
至甘氨酸主要以两性离子的形态存在时(即等电点,此时两性离子间相互吸引力最大),溶解度最小
27.(4分)
(1)0.0600
(2)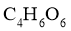
计算过程: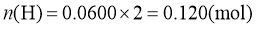 ,
,
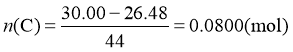 ,
,
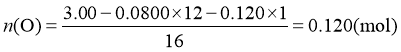 ,
,
最简式为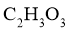 ,由相对分子质量150得分子式为
,由相对分子质量150得分子式为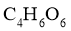 。
。
28.(10分)
(1)
(2)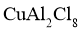
(3)①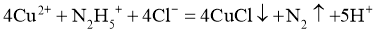
②将白色沉淀溶于硝酸,得到蓝色溶液,说明有 元素;再向溶液中加入
元素;再向溶液中加入 溶液,有白色沉淀,说明有
溶液,有白色沉淀,说明有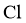 元素
元素
29.(10分)
(1)不同温度下都能自发,是因为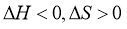
(2)①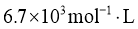 ②
②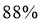
(3)①C ② ③
③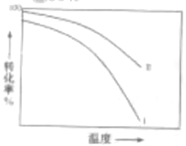
(4)①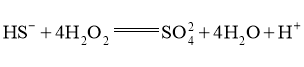
②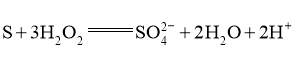
30.(10分)
(1)①浓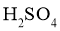 ②
②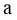
(2)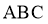 (3)抽气(或通干燥氮气) (4)
(3)抽气(或通干燥氮气) (4)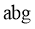
(5)①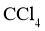 中由紫红色突变到无色
中由紫红色突变到无色
②溶液中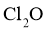 和
和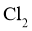 分别为
分别为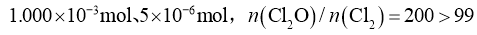 ,符合要求
,符合要求
31.(12分)
(1)
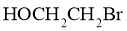
(2)C
(3)
(4)
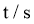
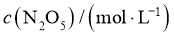
 乙醇,加入
乙醇,加入 浓硫酸、少量沸石,迅速升温至140℃,将产生的气体通入
浓硫酸、少量沸石,迅速升温至140℃,将产生的气体通入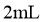 溴水中
溴水中
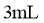 蒸馏水和少量乙醇,振荡,再加入1-2滴
蒸馏水和少量乙醇,振荡,再加入1-2滴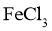 溶液
溶液
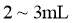 蒸馏水
蒸馏水
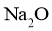 ;若有气体生成,则固体粉末为
;若有气体生成,则固体粉末为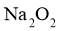
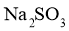 固体样品是否变质
固体样品是否变质
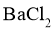 溶液
溶液
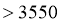
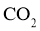 吸收剂
吸收剂