2018年高考理综新课标押题卷及答案

如有排版混乱,请点击全屏查看或下载。
2018年高考理综新课标押题卷及答案
本试题卷共16页,38题(含选考题)。全卷满分300分。考试用时150分钟。
第Ⅰ卷 一、选择题:本题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列与细胞相关的叙述,正确的是( )
A.一般来说,真核细胞比原核细胞的物质运输效率更高
B.与真核细胞相比,原核细胞生物膜仅缺少了核膜这一组成成分
C.B淋巴细胞分化成浆细胞的过程中,线粒体的数目会增多
D.光合作用是能量进入生态系统的主要途径,反应的场所都在叶绿体
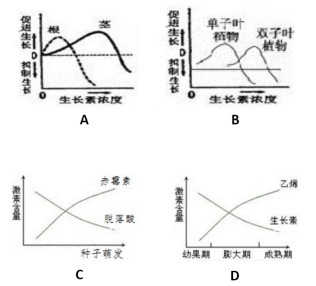
2.下面4幅是植物激素的相关示意图,表示错误的是( )
3.下列关于人体血糖平衡调节的叙述,正确的是( )
A.人体血糖平衡调节是个典型的激素调节过程,没有涉及到神经调节
B.胰岛素分泌量的增加会抑制胰高血糖素的分泌,说明两者之间具有拮抗作用
C.只有在血糖升高时,胰岛B细胞才会分泌胰岛素
D.胰岛素和胰高血糖素都可以遍布于全身
4.下列有关实验的叙述,正确的是( )
A.制作洋葱表皮细胞和口腔上皮细胞临时装片时,都需要滴加清水
B.探究温度对淀粉酶活性影响的实验,可用斐林试剂代替碘液来检测底物变化情况
C.选取经低温诱导的洋葱根尖制成的临时装片,在显微镜下观察不到联会现象
D.酵母菌呼吸方式为兼性厌氧型,改变培养液氧气供应对酵母菌种群的K值没有影响
5.1980年5月18日美国西南的St Helens 火山灾难性爆发。火山灰形成了低营养、剧烈干旱、地表运动频繁的景象。在火山口附近的森林线上选取几个地点分别设立了永久样地,以检测火山爆发后物种数量情况,如下图所示。下列说法正确的是( )
A.火山爆发杀死了森林线上的所有生物,所以1980年开始的演替是初生演替
B.1980年到1982年期间不存在种间竞争,种间竞争在1982年以后才出现
C.从图中可看出本地区物种的环境容纳量(K值)大约为20
D.此生态系统早期的能量来源于火山灰
6.一对夫妇生了个基因型为XBXbY的孩子,已知父亲正常,母亲为色盲携带者。下列分析中正确的是( )
A.问题可能来自父亲,在减数第一次分裂过程中出现了问题
B.问题可能来自父亲,在减数第二次分裂过程中出现了问题
C.问题一定来自母亲,在减数第一次分裂过程中出现了问题
D.问题一定来自母亲,在减数第二次分裂过程中出现了问题
7.下列说法正确的是( )
A.为了防止富脂食品氧化变质,延长食品的保质期,常在包装袋中放入生石灰
B.实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液
C.工业生产玻璃、水泥、漂,均需要用石灰石为原料
D.可以利用氯化铁溶液的酸性清除铜镜表面的铜锈
8.设NA为阿伏加德罗常数值,下列说法正确的是( )
A.1 L0.5 mol/LNaHCO3溶液中含有的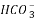 数目小于0.5 NA
数目小于0.5 NA
B.11.2 g 铁粉与硝酸反应失去电子数一定为0.6 NA
C.25℃ 时,pH=13的 Ba(OH)2溶液中含有的OH﹣数目为0.2 NA
D.46 g甲苯含有C=C双键的数目为1.5 NA
9.吲哚-3-乙酸的结构简式如图所示,下列说法正确的是( )
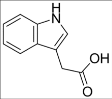 A.能发生银镜发应
A.能发生银镜发应
B.分子式为C10H10NO2
C.1mol 该物质最多可与5mol H2反应
D.吲哚-3-乙酸可发生加成反应和取代反应
10.下列有关实验操作、现象和结论都正确的是( )
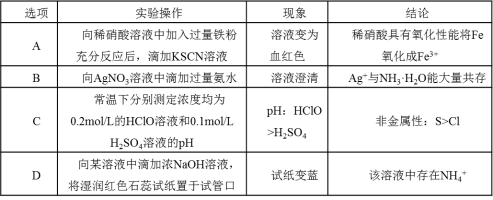
 所得实验数据如下表:
所得实验数据如下表:
 下列说法正确的是( )
下列说法正确的是( )
A.实验①中,若5 min时测得n(N) = 0.050 mol,则0~5min时间内平均反应速率v(P) = 0.015 mo1/(L·min)
B.实验②中达到平衡后,增大压强,M的转化率增大,平衡常数不变
C.600℃时该反应的平衡常数K=3.0
D.实验③中,达到平衡时,x<0.10
12.常温下,用0.1 mol/L NaOH溶液滴定10 mL 0.1 mol/L H2X溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是( )
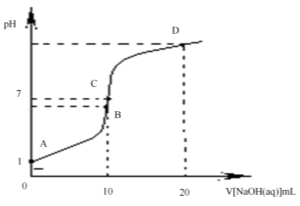
A.水电离出来的c(OH -):D点>B点
B.C点存在关系式:c (Na+) = c (HX-)+ c (X2-)- c(H+)
C.B点:c( HX -)> c (H+)> c (X2-)> c (H2X)
13.短周期主族元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素所在族的族序数之和为18,X和Z元素原子的原子序数比3:4,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是( )
A.X的氧化物的熔点比Y的氧化物的熔点低
B.X的氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
C.简单离子半径:W>Z>Y>X
D.Z的氢化物比W的氢化物更稳定
二、选择题:本题共8小题,每小题6分。在每小题给出的四个选项中,第14~18题只有一项符合题目要求,第19~21题有多项符合题目要求。全部选对的得6分,选对但不全的得3分,有选错的得0分。
14.关于近代物理,下列说法错误的是 ( )
A.轻核聚变反应方程H+H→He+X中,X表示电子
B.α粒子散射实验现象揭示了原子的核式结构
C.分别用红光和紫光照射金属钾表面均有光电子逸出,紫光照射时,逸出的光电子的最大初动能较大
D.基态的一个氢原子吸收一个光子跃迁到n = 3激发态后,可能发射2种频率的光子
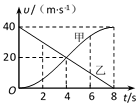 15.甲、乙两车在平直公路上行驶,其速度-时间图象如图所示,则下列说法正确的是( )
15.甲、乙两车在平直公路上行驶,其速度-时间图象如图所示,则下列说法正确的是( )
A.8 s末,甲、乙两车相遇
B.甲车在0~4s内的位移小于乙车在4~8s内的位移
C.4 s末,甲车的加速度小于乙车的加速度
D.在0~8s内,甲车的平均速度小于乙车的平均速度
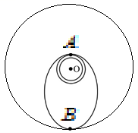 16.卫星发射进入预定轨道往往需要进行多次轨道调整,如图所示,某次发射任务中先将卫星送至近地轨道,然后再控制卫星进入椭圆轨道,最后进入预定圆形轨道运动。图中O点为地心,A点是近地轨道和椭圆轨道的交点,B点是远地轨道与椭圆轨道的交点,远地点B离地面高度为6R(R为地球半径)。设卫星在近地轨道运动的周期为T,下列说法正确的是 ( )
16.卫星发射进入预定轨道往往需要进行多次轨道调整,如图所示,某次发射任务中先将卫星送至近地轨道,然后再控制卫星进入椭圆轨道,最后进入预定圆形轨道运动。图中O点为地心,A点是近地轨道和椭圆轨道的交点,B点是远地轨道与椭圆轨道的交点,远地点B离地面高度为6R(R为地球半径)。设卫星在近地轨道运动的周期为T,下列说法正确的是 ( )
A.控制卫星从图中低轨道进入椭圆轨道需要使卫星减速

C.卫星在近地轨道通过A点的加速度小于在椭圆轨道通过A点时的加速度
D.卫星从A点经4T的时间刚好能到达B点
17.如图甲所示的“火灾报警系统”电路中,理想变压器原、副线圈匝数之比为10:1,原线圈接入图乙所示的电压,电压表和电流表均为理想电表,R0为半导体热敏电阻,其阻值随温度的升高而减小,R1为滑动变阻器。当通过报警器的电流超过某值时,报警器将报警。下列说法正确的是 ( )
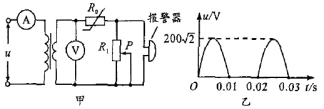
A.电压表V的示数为20V
B.R0处出现火警时,电流表A的示数减小[来源:学科网]
C.R0处出现火警时,变压器的输入功率增大
D.要使报警器的临界温度升高,可将R1的滑片P适当向下移动
 18.如图所示,竖直平面内有一半径为R的固定圆轨道与水平轨道相切于最低点B。一质量为m的小物块P(可视为质点)从A处由静止滑下,经过最低点B后沿水平轨道运动,到C处停下,B、C两点间的距离为R,物块P与圆轨道、水平轨道之间的动摩擦因数均为μ。若将物块P从A处正上方高度为R处由静止释放后,从A处进入轨道,最终停在水平轨道上D点,B、D两点间的距离为s,下列关系正确的是 ( )
18.如图所示,竖直平面内有一半径为R的固定圆轨道与水平轨道相切于最低点B。一质量为m的小物块P(可视为质点)从A处由静止滑下,经过最低点B后沿水平轨道运动,到C处停下,B、C两点间的距离为R,物块P与圆轨道、水平轨道之间的动摩擦因数均为μ。若将物块P从A处正上方高度为R处由静止释放后,从A处进入轨道,最终停在水平轨道上D点,B、D两点间的距离为s,下列关系正确的是 ( )
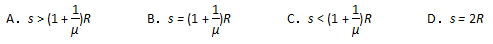
 19.如图所示,在两个点电荷Q1、Q2产生的电场中,实线为其电场线分布,虚线为电子(不计重力)从A点运动到B点的运动轨迹,则下列判断正确的是 ( )
19.如图所示,在两个点电荷Q1、Q2产生的电场中,实线为其电场线分布,虚线为电子(不计重力)从A点运动到B点的运动轨迹,则下列判断正确的是 ( )
A.电子经过A点的加速度比经过B点的加速度大
B.Q1的电荷量小于Q2的电荷量
C.电子在A点的电势能大于在B点的电势能
D.两个点电荷连线中点O的场强为零
20.如图所示,在竖直平面内有一固定的半圆槽,半圆直径AG水平,B、C、D、E、F点将半圆周六等分。现将5个小球1、2、3、4、5(均可视为质点)分别从A点开始向右做平抛运动,分别落到B、C、D、E、F点上,则下列说法正确的是 ( )
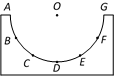 A.各球到达圆周时球3的重力功率最大
A.各球到达圆周时球3的重力功率最大
B.球5做平抛运动的时间最长
C.球3做平抛运动全过程速度变化最大
D.球5到达F点时,速度的反方向延长线不可能过圆心
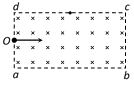 21.如图所示,在长方形abcd区域内,存在方向垂直于纸面向里的匀强磁场,O点为ad边的中点,ab = 2ad。由氕核和氘核(重力不计)组成的一细束粒子流沿与ab平行的方向以相同的速度从O点射入磁场中。下列说法正确的是 ( )
21.如图所示,在长方形abcd区域内,存在方向垂直于纸面向里的匀强磁场,O点为ad边的中点,ab = 2ad。由氕核和氘核(重力不计)组成的一细束粒子流沿与ab平行的方向以相同的速度从O点射入磁场中。下列说法正确的是 ( )
A.氕核和氘核在磁场中运动的轨道半径之比为2∶1
B.若氘核从Od边射出磁场,则氕核和氘核在磁场中运动的时间之比为1∶2
C.若氕核从d点射出磁场,则氕核和氘核在磁场中运动的时间之比为2∶1
D.若氕核从cd边的中点射出磁场,则氘核从cd边射出磁场
第Ⅱ卷
三、非选择题:包括必考题和选考题两部分。第22题~第32题为必考题,每个试题考生都必须做答。第33题~第38题为选考题,考生根据要求做答。
(一)必考题(11题,共129分)
22.(6分)在“练习使用多用电表”实验中,请回答下列问题:
 (1) 甲同学先用多用电表电阻挡“× 100”测量标有“220V 100W”的白炽灯时发现指针偏转角度过大,为了减小测量误差,下列选项中合理的操作顺序为(填写选项前的字母)。
(1) 甲同学先用多用电表电阻挡“× 100”测量标有“220V 100W”的白炽灯时发现指针偏转角度过大,为了减小测量误差,下列选项中合理的操作顺序为(填写选项前的字母)。
A.将选择开关旋转到 “× 1k ”的位置
B.将选择开关旋转到 “× 10 ”的位置
C.用两表笔与白炽灯连接好并读数
D.将两表笔短接,进行欧姆调零
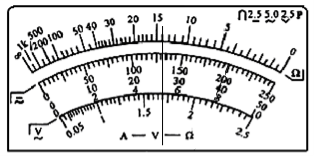
 (2)若甲同学为了减小测量误差,按正确的实验操作,用多用电表电阻挡测量标有“220V 100W”的白炽灯时指针停在图1所示的位置,则此白炽灯电阻的测量值为__Ω。
(2)若甲同学为了减小测量误差,按正确的实验操作,用多用电表电阻挡测量标有“220V 100W”的白炽灯时指针停在图1所示的位置,则此白炽灯电阻的测量值为__Ω。
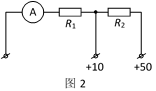 (3)乙同学发现该多用电表“直流50V”挡损坏了,但“直流10V”挡能正常使用。查阅资料知道,电压挡内部原理如图2所示,表头A的满偏电流为1mA。打开多用电表外壳发现电路板上的电阻R2被烧坏了,则乙同学应用阻值为__kΩ的电阻替换R2的位置,就可以修好“直流50V”挡。
(3)乙同学发现该多用电表“直流50V”挡损坏了,但“直流10V”挡能正常使用。查阅资料知道,电压挡内部原理如图2所示,表头A的满偏电流为1mA。打开多用电表外壳发现电路板上的电阻R2被烧坏了,则乙同学应用阻值为__kΩ的电阻替换R2的位置,就可以修好“直流50V”挡。
23.(9分)图示为“探究合力功与物体动能变化的关系”的实验装置,只改变重物的质量进行多次实验,每次小车都从同一位置A由静止释放。请回答下列问题:
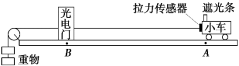
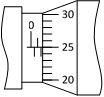
(1)用螺旋测微器测量遮光条的宽度d,其示数如图所示,则d = _____mm。
(2)平衡摩擦力时,___(填“要”或“不要”)挂上重物。
(3)实验时,___(填“需要”或“不需要”)满足重物的总质量远小于小车的总质量(包括拉力传感器和遮光条)。
(4)按正确实验操作后,为了尽可能减小实验误差,若传感器的示数为F,小车总质量为M,重物的总质量为m,A、B两点间的距离为L,遮光条通过光电门的时间为t,则需要测量的物理量是____。
A.M、m、L B.F、M、L、t C.F、m、L、t D.F、M、L
(5)在实验误差允许范围内, 关系式 __成立。(用测量的物理量表示)
 24.(12分)如图所示,两条足够长的固定平行金属导轨的倾角θ = 37°,间距d = 0.2m,电阻不计;矩形区域MNPQ内存在着方向垂直导轨平面向上、磁感应强度大小B = 0.5T的匀强磁场,PM边的长度L1 = 0.64m;将两根用长L2 = 0.2m的绝缘轻杆垂直固定的金属棒ab、ef放在导轨上,两棒质量均为m = 0.05kg,长度均为d,电阻均为R = 0.05Ω,与导轨间的动摩擦因数μ = 0.5。棒从MN上方某处由静止释放后沿导轨下滑,棒ab刚进入MN处时恰好做匀速运动。两棒始终与导轨垂直且接触良好,取g = 10 m/s2,sin37° = 0.6,cos37° = 0.8。求:
24.(12分)如图所示,两条足够长的固定平行金属导轨的倾角θ = 37°,间距d = 0.2m,电阻不计;矩形区域MNPQ内存在着方向垂直导轨平面向上、磁感应强度大小B = 0.5T的匀强磁场,PM边的长度L1 = 0.64m;将两根用长L2 = 0.2m的绝缘轻杆垂直固定的金属棒ab、ef放在导轨上,两棒质量均为m = 0.05kg,长度均为d,电阻均为R = 0.05Ω,与导轨间的动摩擦因数μ = 0.5。棒从MN上方某处由静止释放后沿导轨下滑,棒ab刚进入MN处时恰好做匀速运动。两棒始终与导轨垂直且接触良好,取g = 10 m/s2,sin37° = 0.6,cos37° = 0.8。求:
(1)棒ab刚进入MN处时的速度大小υ1;
(2)棒ab在磁场中的运动时间t。
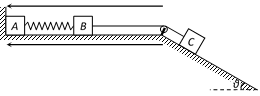 25.(20分)如图所示,在绝缘水平面上的两物块A、B用劲度系数为k的水平绝缘轻质弹簧连接,物块B、C用跨过定滑轮的绝缘轻绳连接,A靠在竖直墙边,C在倾角为θ的长斜面上,滑轮两侧的轻绳分别与水平面和斜面平行。A、B、C的质量分别是m、2m、2m,A、C均不带电,B带正电,滑轮左侧存在着水平向左的匀强电场,整个系统不计一切摩擦,B与滑轮足够远。B所受的电场力大小为6mgsinθ,开始时系统静止。现让C在沿斜面向下的拉力F作用下做加速度大小为a的匀加速直线运动,弹簧始终未超过弹性限度,重力加速度大小为g。
25.(20分)如图所示,在绝缘水平面上的两物块A、B用劲度系数为k的水平绝缘轻质弹簧连接,物块B、C用跨过定滑轮的绝缘轻绳连接,A靠在竖直墙边,C在倾角为θ的长斜面上,滑轮两侧的轻绳分别与水平面和斜面平行。A、B、C的质量分别是m、2m、2m,A、C均不带电,B带正电,滑轮左侧存在着水平向左的匀强电场,整个系统不计一切摩擦,B与滑轮足够远。B所受的电场力大小为6mgsinθ,开始时系统静止。现让C在沿斜面向下的拉力F作用下做加速度大小为a的匀加速直线运动,弹簧始终未超过弹性限度,重力加速度大小为g。
(1)求弹簧的压缩长度x1;
(2)求A刚要离开墙壁时C的速度大小υ1及拉力F的大小;
(3)若A刚要离开墙壁时,撤去拉力F,同时电场力大小突然减为2mgsinθ,方向不变,求在之后的运动过程中弹簧的最大弹性势能Epm。
26.(14分)碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为:
LaCl3+6NH4HCO3= La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
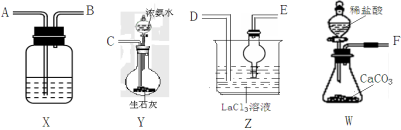
(1)盛放稀盐酸的仪器为 。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→ → → → → 。
(3)Y中发生反应的化学反应式为_。
(4)X中盛放的试剂是 ,其作用为 。
(5)Z中应先通入NH3,后通入过量的CO2,原因为___ 。
(6)La2(CO3)3质量分数的测定:准确称取10.0g产品试样,溶于10.0mL稀盐酸中,加入10 mL NH3-NH4Cl缓冲溶液,加入0.2 g紫脲酸铵混合指示剂,用0.5 mol·L-1 EDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La 3++H2Y2-= LaY-+2H+),消耗EDTA溶液44.0 mL。则产品中La2(CO3)3的质量分数w[La2(CO3)3]=
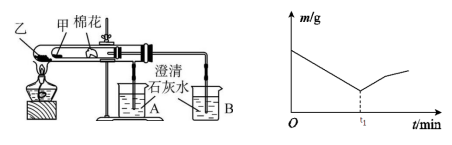
(7)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为 ;实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示。在t1 min之后固体质量增加的原因可能是_。
27.(14分)燃煤能排放大量的 CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2 也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)PM2.5是指大气中直径小于或等于2.5微米的可入肺的有害颗粒,下列有关说法中正确的是( )
a.PM2.5空气中形成了胶体
b.PM2.5表面积能大面积吸附大量的有毒有害物质
c.机动车尾气排放等过程中经过燃烧而排放的残留物,大多还有重金属等有毒物质
d.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染

则表示CH3OH(l)燃烧热的热化学方程式为__。
 一容积可变的密闭容器中充入 10mol CO 和 20mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示。
一容积可变的密闭容器中充入 10mol CO 和 20mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示。
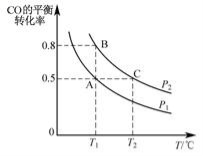 ①下列说法不能判断该反应达到化学平衡状态的是____(填字母)。
①下列说法不能判断该反应达到化学平衡状态的是____(填字母)。
a.H2 的消耗速率等于 CH3OH 的生成速率的 2 倍
b.H2 的体积分数不再改变
c.体系中 H2 的转化率和 CO 的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较 A、B 两点压强大小 PA_____PB(填“>”“<”或“=”)。
③若达到化学平衡状态 A 时,容器的体积为 20 L。如果反应开始时仍充入 10 mol CO 和 20 mol H2,则在平衡状态 B 时容器的体积 V(B)=____L。
(4)SO2 在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图:
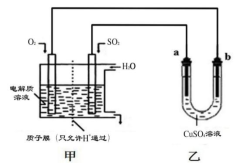
①该电池的负极反应:___ ;
②当甲中消耗2.24 L O2(标准状况)时,乙中 (填“a”或“b”)增重__g。
28.(15分)三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如图所示:
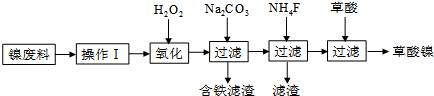
请回答下列问题:
(1)操作Ⅰ为 __ 。
(2)①加入H2O2发生的主要反应的离子方程式为 ___ ;
②加入碳酸钠溶液调pH至4.0~5.0,其目的为 ___ 。
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体。NiC2O4受热分解的化学方程式为 _ 。
(4)工业上还可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO﹣,再把二价镍氧化为三价镍。ClO﹣氧化Ni(OH)2生成Ni2O3的离子方程式为 _____ 。a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 __ 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 _ 。
29.(9分)某些核糖体不仅是“生产蛋白质的机器”,还可以催化氨基酸进行脱水缩合反应。用蛋白酶处理后此功能仍然存在。回答下列问题。
(1)核糖体不含磷脂,同样不含磷脂的细胞器还有 。
(2)题干中提及的起催化作用物质的化学本质是__,构成它的单体有 种。
(3)氨基酸脱水缩合形成的化学键结构式为__ 。人的血红蛋白由4条(α、α、β、β)多肽链组成,其中每条α链含氨基酸141个,每条β链含氨基酸146个,则血红蛋白含肽键数为 个。
30.(11分)图甲为研究光照强度对某植物光合作用强度实验示意图,图乙为测量结果,请据图回答下列问题:
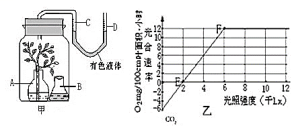
(1)图甲B容器中装的溶液是__ ,目的是___ 。
(2)当光照强度维持在1kLx时,图甲中的有色液体 侧(C/D)较高。
(3)图乙中的E点称为__ ,此时实际光合速率为 mg/100cm叶面积·小时;适当增加密封瓶内CO2浓度,F点向 移动。
31.(10分)下图为某健康成年人分别饮1升清水及饮1升生理盐水后的尿生成速率曲线图,回答下列问题。
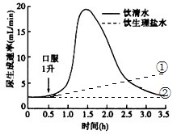
(1)饮1L清水后,位于__ 的感受器接受到了刺激后,由__分泌的抗利尿激素__ (增加/减少)。
(2)图中饮1L生理盐水后,尿生成速率为图中的 (①/②)曲线。盛夏季节高温作业人群应多喝淡盐水,目的是_____ 。
32.(9分)已知果蝇的长翅与残翅是一对相对性状(A、a),刚毛与截毛是一对相对性状(B、b),下图为某雄性果蝇体细胞染色体组成及相关基因分布示意图。使该雄性果蝇与一雌性果蝇杂交,后代的表现型及比例如表格中所示。回答下列问题。
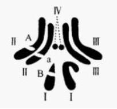

(1)亲代中雌性果蝇的基因型为 ,后代中与亲代基因型相同的果蝇占后代总数的 。
(2)现有一只与亲代雄性表现型相同的果蝇,为证明它们的基因型是否也相同,某同学进行了测交实验,请预测实验现象及结论。
(3)已知另一相对性状的基因在X染色体和Y染色体上都存在(位于X、Y染色体的同源区段),其遗传是否能表现为伴性遗传?请举一例,支持你的观点。
(二)选考题(6题,共45分,请考生从各科2道试题中任选一题作答。如果多做,则按所做的第一题计分。)
33.【物理—选修3-3】(15分)
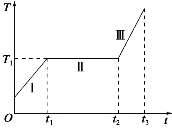 (1)(5分)质量一定的某种物质,在压强不变的条件下,由固态Ⅰ到气态Ⅲ变化过程中温度T随加热时间t变化关系如图所示,单位时间所吸收的热量可看做不变,气态Ⅲ可看成理想气体。下列说法正确的是___(填正确答案标号,选对一个得2分,选对2个得4分,选对3个得5分。每选错一个扣3分,最低得分为0分 )
(1)(5分)质量一定的某种物质,在压强不变的条件下,由固态Ⅰ到气态Ⅲ变化过程中温度T随加热时间t变化关系如图所示,单位时间所吸收的热量可看做不变,气态Ⅲ可看成理想气体。下列说法正确的是___(填正确答案标号,选对一个得2分,选对2个得4分,选对3个得5分。每选错一个扣3分,最低得分为0分 )
A.该物质是晶体
B.该物质分子平均动能随着时间的增加而增大
C.在t1~t2时间内,该物质分子势能随着时间的增加而增大
D.在t2~t3时间内,该物质的内能随着时间的增加而增大
E.在t2~t3时间内,气体膨胀对外做功,分子势能增大
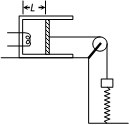 (2)(10分)如图所示,封闭有一定质量理想气体的长气缸固定在水平桌面上,开口向右,活塞的横截面积为S。活塞与质量为m的物块用跨过定滑轮上的轻绳连接,滑轮两侧的轻绳分别处于水平和竖直状态,劲度系数为k的竖直轻弹簧下端固定,上端与物块连接。开始时,活塞与气缸底部的间距为L,绝对温度为T1,弹簧处于拉伸状态且弹力大小F1 = mg。已知大气压p0 = (n > 2,g为重力加速度大小)。不计一切摩擦,弹簧始终处于弹性限度内。求:
(2)(10分)如图所示,封闭有一定质量理想气体的长气缸固定在水平桌面上,开口向右,活塞的横截面积为S。活塞与质量为m的物块用跨过定滑轮上的轻绳连接,滑轮两侧的轻绳分别处于水平和竖直状态,劲度系数为k的竖直轻弹簧下端固定,上端与物块连接。开始时,活塞与气缸底部的间距为L,绝对温度为T1,弹簧处于拉伸状态且弹力大小F1 = mg。已知大气压p0 = (n > 2,g为重力加速度大小)。不计一切摩擦,弹簧始终处于弹性限度内。求:
(i)若对被封闭气体缓慢加热直至弹簧弹力大小为零,求此时被封闭气体的绝对温度T2;
(ii)当被封闭气体的绝对温度为T2时,立即撤去弹簧且不再对被封闭气体加热,经过一段较长时间后,被封闭气体的绝对温度又降回到T1,求此时活塞与气缸底部的间距L′。
34.【物理—选修3-4】(15分)
(1)(5分)如图所示,一绳子Ox上有—系列的质点A、B、C……,相邻质点的间距离均为0.2m。当t = 0时,波源A从平衡位置开始向上做简谐运动,经过0.4s刚好第一次回到平衡位置,此时质点E刚好开始振动。若波源简谐运动的振幅为3cm,则下列说法正确的是 ___(填正确答案标号,选对一个得2分,选对2个得4分,选对3个得5分。每选错一个扣3分,最低得分为0分 )
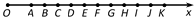 A.波的传播速度为2m/s,周期为0.4s
A.波的传播速度为2m/s,周期为0.4s
B.波的频率为1.25Hz,波长为1.6m
C.t = 0.6s,质点G刚好开始振动,此时质点F的加速度方向向下
D.在0~0.8s内,波源A的路程为1.6m
E.当质点K处于波谷时,质点G一定处于波峰
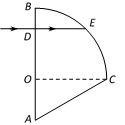 (2)(10分)如图所示,某种透明介质的截面图由直角三角形AOC和圆心为O、半径为R的四分之一圆弧BC组成,其中∠A = 60°。一束单色光从D点垂直AB面射入透明介质中,射到圆弧BC上时恰好发生全反射。已知D点与O点之间的距离为,光在真空中的传播速度为c。求:
(2)(10分)如图所示,某种透明介质的截面图由直角三角形AOC和圆心为O、半径为R的四分之一圆弧BC组成,其中∠A = 60°。一束单色光从D点垂直AB面射入透明介质中,射到圆弧BC上时恰好发生全反射。已知D点与O点之间的距离为,光在真空中的传播速度为c。求:
(i)单色光在介质中的传播速度υ;
(ii)单色光第一次射出介质时折射角θ。
35.【化学--选修3:物质结构与性质】(15分)已知X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素。5种元素的部分特点:
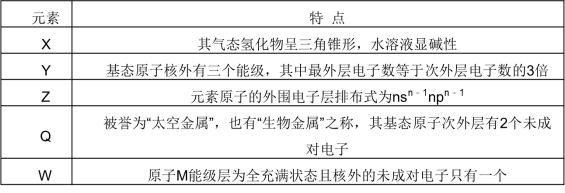 (1)XF3分子中A的杂化类型为 ,该分子的空间构型为 。
(1)XF3分子中A的杂化类型为 ,该分子的空间构型为 。
(2)基态Q原子的电子排布式为 ,第一电离能:X Y(填“>” “<”或“=”)。
(3)X、Y、Z电负性由大到小的顺序为 (用元素符号表示)。
 (4)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于 晶体。
(4)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于 晶体。
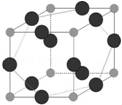
(5)W元素与X元素形成某种化合物的晶胞结构如图所示(黑球代表W原子),若该晶体的密度为ρ g·cm-3,则该晶胞的体积是 __ cm3。
36.【化学--选修5:有机化学基础】(15分)某抗结肠炎药物的有效成分的合成路线如下所示(部分试剂和反应条件已略去):
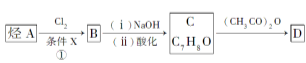

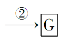
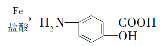
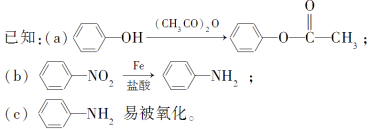
请回答下列问题:
(1)C的结构简式是__。
(2)①的反应条件是__;②的反应类型是___。
(3)下列对抗结肠炎药物的有效成分可能具有的性质推测正确的是___(填字母)。
a.水溶性比苯酚的好,密度比苯酚的大
b.能发生消去反应
c.能发生加聚反应
d.既有酸性又有碱性
(4)E与足量NaOH溶液反应的化学方程式为__。
(5)符合下列条件的E的同分异构体有___种。写出其中核磁共振氢谱中有四组峰的结构简式:_____。
a.与E具有相同的官能团且官能团不在同一侧链上
b.水解产物之一能与氯化铁溶液发生显色反应
(6)连有烷基的苯环上再引入一个取代基时,常取代烷基邻、对位上的氢原子,而连有羧基的苯环上再引入一个取代基时,常取代羧基间位上的氢原子。据此设计出以A为原料合
37.【生物—选修一:生物技术实践】(15分)在某实验中选用YMA根瘤菌固体培养基来培养费氏中华根瘤菌(自生固氮菌),配方如下表所示。
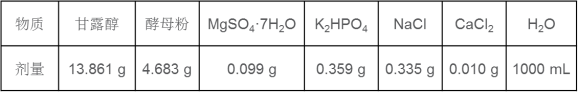
回答下列问题。
(1)按物理性质,培养基可分为 和固体培养基;培养基的配置过程具有如下步骤:①灭菌 ②计算 ③倒平板 ④调pH ⑤称量 ⑥溶化 ,正确是顺序为__ 。费氏中华根瘤菌以 作为碳源。
(2)想要测定某一时期活菌数量,可选用 法进行计数。为了保证结果准确,一般选择菌落数在 的平板进行计数。
(3)此实验是如果防止污染的?
38.【生物—选修三:现代生物科技专题】(15分)白细胞介素-1(IL-1)是重要的炎性介质之一,也是一种热原质成分,具有致热和介导炎症的作用。它主要在细胞免疫激活中发挥调节作用。某项目小组利用基因工程技术大量合成IL-1,在pBV220载体(图A)多克隆位点的EcoRⅠ和BamHⅠ酶切位点之间插入目的基因IL1-His,构建表达载体pBV-IL1-His(图B)。转化感受态细胞(大肠杆菌),通过选择性培养基(Ampr)和菌体PCR法筛选重组子阳性克隆。在适宜条件下培养并诱导目的蛋白的表达,最后利用His抗体进行蛋白质印迹检测表达情况。
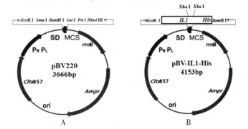
(1)在上述实验中,为了防止目的基因和pBV220载体在酶切后的末端发生任意连接,酶切时应选用的酶是___ 。目的基因的长度为 pb(重组质粒上目的基因的插入位点与酶切位点之间的碱基对忽略不计)。pBV-IL1-His表达载体除了氨苄青霉素抗性基因(Ampr)、目的基因外还必须具有 等基因。
(2)转化感受态大肠杆菌时需要用 处理细胞。利用PCR技术体外扩增DNA时,需将双链DNA加热到90℃以上,目的是 。
(3)最后是通过__ 技术来检验实验是否成功。假设未检测出目的蛋白,分析可能的原因有_____。(写出一种即可)






